Термодинамические свойства компонентов в смеси.
Термодинамические свойства компонентов в смеси.
Реальные газыотличаются от идеальных газов для конкретных объёма, температуры и количества вещества величиной Р и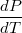 . Величина
. Величина 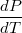 своим отличаем от
своим отличаем от 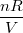 , обязана наличием у молекул конечного объёма, тогда
, обязана наличием у молекул конечного объёма, тогда 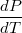 =
=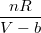 , , где b – определяет этот занятый объём. Тогда Р=
, , где b – определяет этот занятый объём. Тогда Р=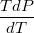 -А, где А – определяет величину молекулярного притяжения. Тогда изменение энтропии при деформации в изотермическом режиме равно dS=
-А, где А – определяет величину молекулярного притяжения. Тогда изменение энтропии при деформации в изотермическом режиме равно dS=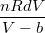 , , Рассмотренные параметры можно определять для любого компонента смеси.
, , Рассмотренные параметры можно определять для любого компонента смеси.
Последний раз редактировалось juriy 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Термодинамические свойства компонентов в смеси.
Не все так примитивно. Проблема описания термодинамических свойств многокомпонентной смеси реальных газов далека от своего полного разрешения, однако ее состояние на конец 70-х годов прошлого века хорошо изложено в справочнике: Р. Рид, Дж. Праусниц, Т. Шервуд. Свойства газов и жидкостей. Л., Химия, 1982. Рекомендую.
Последний раз редактировалось Pyotr 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Термодинамические свойства компонентов в смеси.
| M | З Юрий, проявляйте уважение к вашим собеседникам и следующий свой пост, в котором будут присутствовать формулы, оформляйте в соответствии с правилами форума -- в LaTeX. |
| A | З Юрий, проявляйте уважение к вашим собеседникам и следующий свой пост, в котором будут присутствовать формулы, оформляйте в соответствии с правилами форума -- в LaTeX. |
Последний раз редактировалось Рубен 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Термодинамические свойства компонентов в смеси.
Pyotr писал(а):Source of the post
Не все так примитивно. Проблема описания термодинамических свойств многокомпонентной смеси реальных газов далека от своего полного разрешения, однако ее состояние на конец 70-х годов прошлого века хорошо изложено в справочнике: Р. Рид, Дж. Праусниц, Т. Шервуд. Свойства газов и жидкостей. Л., Химия, 1982. Рекомендую.
А я и не говорю, что всё так просто, так как величины А и b являются сложными функциями от V и T. Но в каждом конкретном случае они имеют свои значения и это не возможно отрицать. А вводятся они именно потому, что они выражают силы молекулярного притяжения и объём вытесненый молекулами в чистом виде.
Последний раз редактировалось juriy 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Термодинамические свойства компонентов в смеси.
juriy писал(а):Source of the postPyotr писал(а):Source of the post
Не все так примитивно. Проблема описания термодинамических свойств многокомпонентной смеси реальных газов далека от своего полного разрешения, однако ее состояние на конец 70-х годов прошлого века хорошо изложено в справочнике: Р. Рид, Дж. Праусниц, Т. Шервуд. Свойства газов и жидкостей. Л., Химия, 1982. Рекомендую.
А я и не говорю, что всё так просто, так как величины А и b являются сложными функциями от V и T. Но в каждом конкретном случае они имеют свои значения и это не возможно отрицать. А вводятся они именно потому, что они выражают силы молекулярного притяжения и объём вытесненый молекулами в чистом виде.
Вы привели конкретные формулы, справедливые для определенного уравнения состояния (для ясности его следовало бы выписать). В упомянутом справочнике помимо обычного вириального разложения рассмотрено несколько наиболее употребительных вариантов уравнения состояния смеси реальных газов, каждое из которых приводит к своим выражениям для величин
Последний раз редактировалось Pyotr 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Термодинамические свойства компонентов в смеси.
Pyotr писал(а):Source of the postjuriy писал(а):Source of the postPyotr писал(а):Source of the post
Не все так примитивно. Проблема описания термодинамических свойств многокомпонентной смеси реальных газов далека от своего полного разрешения, однако ее состояние на конец 70-х годов прошлого века хорошо изложено в справочнике: Р. Рид, Дж. Праусниц, Т. Шервуд. Свойства газов и жидкостей. Л., Химия, 1982. Рекомендую.
А я и не говорю, что всё так просто, так как величины А и b являются сложными функциями от V и T. Но в каждом конкретном случае они имеют свои значения и это не возможно отрицать. А вводятся они именно потому, что они выражают силы молекулярного притяжения и объём вытесненый молекулами в чистом виде.
Вы привели конкретные формулы, справедливые для определенного уравнения состояния (для ясности его следовало бы выписать). В упомянутом справочнике помимо обычного вириального разложения рассмотрено несколько наиболее употребительных вариантов уравнения состояния смеси реальных газов, каждое из которых приводит к своим выражениям для величини
.
Я почитал справочник, да в нём излагается большой материал накопленный человечеством для решения тех или иных конкретных задач в основном для обеспечения химического производства. Хотя изначально признаётся отличием реальных газов от идеальных наличие конечного объёма молекул и способность молекул к притяжению. Эти два фактора различной природы не изучаются отдельно, а делаются попытки поиска различных эмпирических уравнениях состояния, причём поправку b в лучшем случае принимают за постоянную. В результате в области высоких давлений и вблизи критических значений остаётся много не ясного. Я же предлагаю поправки А и b изучать отдельно согласно их природы. Моя же методика выделения этих поправок не опровергается, так как она и материалы справочника основаны на соотношении Максвелла.
Последний раз редактировалось juriy 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Термодинамические свойства компонентов в смеси.
juriy писал(а):Source of the post
Я почитал справочник, да в нём излагается большой материал накопленный человечеством для решения тех или иных конкретных задач в основном для обеспечения химического производства. Хотя изначально признаётся отличием реальных газов от идеальных наличие конечного объёма молекул и способность молекул к притяжению. Эти два фактора различной природы не изучаются отдельно, а делаются попытки поиска различных эмпирических уравнениях состояния, причём поправку b в лучшем случае принимают за постоянную. В результате в области высоких давлений и вблизи критических значений остаётся много не ясного. Я же предлагаю поправки А и b изучать отдельно согласно их природы. Моя же методика выделения этих поправок не опровергается, так как она и материалы справочника основаны на соотношении Максвелла.где
, а
получаем
, где если заменить
получим мою формулу.
Да ради бога. Феноменологические представления о влиянии объема молекул и их притяжения на уравнение состояния однокомпонентной среды позволило Ван-дер-Ваальсу около ста лет назад сформулировать знаменитое уравнение, которое не потеряло своего значения вплоть до настоящего времени. В реальности природа обоих рассматриваемых факторов, разумеется, едина и обусловлена влиянием потенциала межмолекулярного взаимодействия на свойства среды.
Последний раз редактировалось Pyotr 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Термодинамические свойства компонентов в смеси.
Pyotr писал(а):Source of the post
Да ради бога. Феноменологические представления о влиянии объема молекул и их притяжения на уравнение состояния однокомпонентной среды позволило Ван-дер-Ваальсу около ста лет назад сформулировать знаменитое уравнение, которое не потеряло своего значения вплоть до настоящего времени. В реальности природа обоих рассматриваемых факторов, разумеется, едина и обусловлена влиянием потенциала межмолекулярного взаимодействия на свойства среды.
.Тут необходио отметить, что увеличение степени присудствия посторонненго компонента увеличевает b и тогда из нашего уравнения
Последний раз редактировалось juriy 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Термодинамические свойства компонентов в смеси.
juriy писал(а):Source of the postPyotr писал(а):Source of the post
Да ради бога. Феноменологические представления о влиянии объема молекул и их притяжения на уравнение состояния однокомпонентной среды позволило Ван-дер-Ваальсу около ста лет назад сформулировать знаменитое уравнение, которое не потеряло своего значения вплоть до настоящего времени. В реальности природа обоих рассматриваемых факторов, разумеется, едина и обусловлена влиянием потенциала межмолекулярного взаимодействия на свойства среды.
.Тут необходио отметить, что увеличение степени присудствия посторонненго компонента увеличевает b и тогда из нашего уравнениядолжно возростать парциальное давление нашего компонента при неизменном
, что наблюдается при растворении мало летучего вещества летучим. Так для устранения жирного пятна достаточно его смочить спиртом. Есть ещё и явление влажного каната.
Все это было бы замечательно, если бы Ваша теория не приводила к нарушению термодинамических соотношений, справедливость которых подтверждает вся имеющаяся практика.
Последний раз редактировалось Pyotr 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Термодинамические свойства компонентов в смеси.
[quote name='Pyotr' date='7.1.2012, 18:23' post='333806']
[quote name='З Юрий' post='333737' date='7.1.2012, 17:49']
[quote name='Pyotr' post='333695' date='7.1.2012, 10:26']
Да ради бога. Феноменологические представления о влиянии объема молекул и их притяжения на уравнение состояния однокомпонентной среды позволило Ван-дер-Ваальсу около ста лет назад сформулировать знаменитое уравнение, которое не потеряло своего значения вплоть до настоящего времени. В реальности природа обоих рассматриваемых факторов, разумеется, едина и обусловлена влиянием потенциала межмолекулярного взаимодействия на свойства среды.
[/quote]
.Тут необходио отметить, что увеличение степени присудствия посторонненго компонента увеличевает b и тогда из нашего уравнения должно возростать парциальное давление нашего компонента при неизменном
должно возростать парциальное давление нашего компонента при неизменном  , что наблюдается при растворении мало летучего вещества летучим. Так для устранения жирного пятна достаточно его смочить спиртом. Есть ещё и явление влажного каната.
, что наблюдается при растворении мало летучего вещества летучим. Так для устранения жирного пятна достаточно его смочить спиртом. Есть ещё и явление влажного каната.
[/quote] Все это было бы замечательно, если бы Ваша теория не приводила к нарушению термодинамических соотношений, справедливость которых подтверждает вся имеющаяся практика.
[./quote]
Позвольте, но я операюсь исключительно на практические знания в чём вы меня не можете упрекнуть.
[quote name='З Юрий' post='333737' date='7.1.2012, 17:49']
[quote name='Pyotr' post='333695' date='7.1.2012, 10:26']
Да ради бога. Феноменологические представления о влиянии объема молекул и их притяжения на уравнение состояния однокомпонентной среды позволило Ван-дер-Ваальсу около ста лет назад сформулировать знаменитое уравнение, которое не потеряло своего значения вплоть до настоящего времени. В реальности природа обоих рассматриваемых факторов, разумеется, едина и обусловлена влиянием потенциала межмолекулярного взаимодействия на свойства среды.
[/quote]
.Тут необходио отметить, что увеличение степени присудствия посторонненго компонента увеличевает b и тогда из нашего уравнения
[/quote] Все это было бы замечательно, если бы Ваша теория не приводила к нарушению термодинамических соотношений, справедливость которых подтверждает вся имеющаяся практика.
[./quote]
Позвольте, но я операюсь исключительно на практические знания в чём вы меня не можете упрекнуть.
Последний раз редактировалось juriy 28 ноя 2019, 17:47, всего редактировалось 1 раз.
Причина: test
Причина: test
Вернуться в «Альтернативная наука»
Кто сейчас на форуме
Количество пользователей, которые сейчас просматривают этот форум: нет зарегистрированных пользователей и 2 гостей