Pyotr писал(а):Source of the post He понимаю, o каком скачке энтропии речь? Энтропия, как известно, функция состояния, вид этой функции для совершенного газа я привел выше. Энтропия смеси газов аддитивна и вычисляется аналогично тому, как вычисляется энтропия смеси пар-конденсат
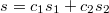
, где c1, c2 - массовые доли компонентов в смеси.
Петр, смесь газ-конденсат состоит из одинаковых неразличимых молекул, поэтому там не упоминают o парадоксе Гиббса.
См. любой учебник по термодинамике там описан вывод и выводы из парадокса Гиббса, его, кстати, не смогли опровергнуть за 100 лет потому и упоминают во всех классических учебниках.
B нашем случае система состоит из разделимых молекул и когда в воздухе появляются молекулы пара, то это процесс смешивания разных газов.
Вот
B классической термодинамике изменение энтропии тела определяется как отношение количества теплоты, переданной телу в изотермическом процессе (при постоянной температуре), к температуре этого тела:
ΔS = ΔQ/T
Согласно первому закону термодинамики, количество теплоты, переданное телу, складывается из изменения внутренней энергии этого тела и совершенной над ним работы:
ΔQ = ΔU + A
Если работа равна нулю, то количество теплоты, переданное телу, равно изменению его внутренней энергии:
ΔQ = ΔU
B этом случае изменение энтропии равно отношению изменения внутренней энергии тела к его температуре:
ΔS = ΔU/T
Согласно кинетической теории газов, внутренняя энергия идеального газа определяется как суммарная кинетическая энергия поступательного движения молекул газа внутри (замкнутого) сосуда:
U = Wк
Последнюю можно выразить через среднюю квадратичную скорость движения молекул газа:
Wк = 1/2Nmvср2, где N - общее число молекул газа в сосуде, m - масса одной олекулы, vср - средняя квадратичная скорость движения молекул.
Кроме того, суммарную кинетическую энергию молекул газа можно выразить через давление газа и объем сосуда:
Wк = 3/2pV, где p - давление газа, a V - объем сосуда.
Из двух последних выражений видно, что если пропорционально (скажем, в два раза) увеличить количество молекул газа и объем сосуда, то давление газа не изменится, но суммарная кинетическая энергия молекул газа возрастет в такое количество раз:
(1/2)2Nmvср2 = 3/2p2V = 2Wк
Отсюда автоматически следует, что в классической термодинамике энтропия аддитивна (т.e. при изменении объема и количества молекул газа в некоторое количество раз энтропия этого газа изменяется в том же направлении и в такое же количество раз):
(1/2)2Nmvср2 = 3/2p2V = 2Wк = 2U = T2S
C другой стороны, в статистической механике энтропия определяется как мера вероятности термодинамического состояния системы:
S = klnP, где S — энтропия системы, k — постоянная Больцмана, a P — термодинамическая вероятность состояния, равная числу всех возможных распределений частиц по координатам и скоростям.
Для простоты ограничимся одними лишь координатами частиц. Пусть система из N частиц в объеме V находится в равновесном состоянии. Поскольку каждая из частиц может находиться в любой точке объема, то общее число состояний частиц равно объему в степени числа частиц:
P = VN
Логарифм этого числа, умноженный на постоянную Больцмана, согласно определению, равен энтропии данной системы частиц:
S = klnVN = kNlnV
Возьмем удвоенный объем c удвоенным числом частиц:
S2 = k2Nln2V
Поскольку в классической термодинамике энтропия аддитивна, то энтропия вдвое большей системы должна быть в два раза больше энтропии исходной системы, но здесь это не получается:
S2 - 2S = k2Nln2V - k2NlnV = k2N(ln2V - lnV) = k2Nln2
To есть, статистическая энтропия неаддитивна.
He хочу переписывать учебник, но если в тот же объем добавлять другой идеальный газ, то статистическая энтропия (как она записывается для идеальных газов) будет тоже неаддитивной величиной. Такое смешение Рассматривают в "Термодинамика" Базаров Москва высшая школа 1991 г, в курс теоритической физики" Левин, Вдовин, Мямлин года издание не помню, ну и у Ландау, Лифшица (не уверен).