Что там под кривой?
Что там под кривой?
Возьмем график функции роста энтропии в дали от фазовых переходов, т.е. по оси абсцисс будет температура а по оси ординат - энтропия (функция S(T)). Тогда чему будет равна площадь под кривой, ограниченной температурами T2 и T2, т.е. интеграл 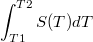 ?
?
Последний раз редактировалось x.750 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Что там под кривой?
Ладно, спрошу по другому... Формула расчета изменения энтропии от температуры:  почему изменение энтропии от T1 до T2 равно теплоемкость/температуру? и на какую температуру, если она меняется от T1 до T2 ???
почему изменение энтропии от T1 до T2 равно теплоемкость/температуру? и на какую температуру, если она меняется от T1 до T2 ???
Последний раз редактировалось x.750 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Что там под кривой?
x.750 писал(а):Source of the post
Ладно, спрошу по другому... Формула расчета изменения энтропии от температуры:почему изменение энтропии от T1 до T2 равно теплоемкость/температуру? и на какую температуру, если она меняется от T1 до T2 ???
1. Из определения энтропии
2. Текущая.
Последний раз редактировалось Pyotr 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Что там под кривой?
При изменении температуры от Т1 до Т2 изменится внутреняя энергия системы, равная грубо говоря изменению энтальпии. Далее  а в формуле наоборот c_p / T :blink: как это?
а в формуле наоборот c_p / T :blink: как это?
Последний раз редактировалось x.750 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Что там под кривой?
x.750 писал(а):Source of the post
При изменении температуры от Т1 до Т2 изменится внутреняя энергия системы, равная грубо говоря изменению энтальпии. Далееа в формуле наоборот c_p / T :blink: как это?
Все видно из определения энтропии.
Последний раз редактировалось Pyotr 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Что там под кривой?
Мне не видно... :search: размерность теплоёмкости Дж/(моль*К) если ещё разделить на температуру то будет Дж/(моль*К^2) а такой энтропии не бывает...
Последний раз редактировалось x.750 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Что там под кривой?
Последний раз редактировалось Pyotr 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Что там под кривой?
Почему так? dU+pdV = dH, а dH = TdS в состояния равновесия, которое к этому не имеет никакого отношения...?
Последний раз редактировалось x.750 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Что там под кривой?
И откуда VdP взялось? Если V=const то работы расширения не производится и VdP = 0...
Последний раз редактировалось x.750 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Что там под кривой?
x.750 писал(а):Source of the post
Почему так? dU+pdV = dH, а dH = TdS в состояния равновесия, которое к этому не имеет никакого отношения...?
При чем здесь энтальпия? Вот запись первого начала термодинамики, где U -внутренняя энергия, dQ - подведенное тепло:
dU+pdV = dQ
А это определение энтропии:
dS=dQ/T
x.750 писал(а):Source of the post
И откуда VdP взялось? Если V=const то работы расширения не производится и VdP = 0...
dU+pdV=d(U+pV)-Vdp
Последний раз редактировалось Pyotr 28 ноя 2019, 21:33, всего редактировалось 1 раз.
Причина: test
Причина: test
Кто сейчас на форуме
Количество пользователей, которые сейчас просматривают этот форум: нет зарегистрированных пользователей и 3 гостей