Это вообще решаемо?
Добавлено: 27 дек 2007, 23:13
Через водный раствор хлорида натрия(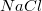 ) пропускали в течение 160.8 минут постоянный электрический ток силой 10A. Электроды инертные. Определить какие вещества, и в каком количестве образовались на электродах.
) пропускали в течение 160.8 минут постоянный электрический ток силой 10A. Электроды инертные. Определить какие вещества, и в каком количестве образовались на электродах.
Я уже четвёртую неделю над шестью задачками сижу, последние две(эта одна из них) вообще нерешаемы.
Я уже четвёртую неделю над шестью задачками сижу, последние две(эта одна из них) вообще нерешаемы.