СЛОЖНАЯ ЗАДАЧА ПРО металлы
СЛОЖНАЯ ЗАДАЧА ПРО металлы
Магниевые опилки массой 12 г погрузили в раствор сульфата меди. после завершения реакции металлический осадок отделили, его масса 20 г. рассчитать минимальный объем раствора азотной кислоты массовая доля которой 36%, плотность 1,22 г/мл, который потребуется для растворения полученного металлического осадка.
Последний раз редактировалось Старик 30 ноя 2019, 12:54, всего редактировалось 1 раз.
Причина: test
Причина: test
СЛОЖНАЯ ЗАДАЧА ПРО металлы
Вот уравнение реакции для этой задачи:
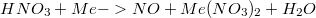
И еще две задачки:
2.Цинковая пластинка массой 10 гр. опущена в раствор
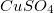 . После окончания реакции промытая и высушенная пластинка имеет массу 9,9 гр. Объяснить изменение массы пластинки и определить массу
. После окончания реакции промытая и высушенная пластинка имеет массу 9,9 гр. Объяснить изменение массы пластинки и определить массу 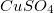 в растворе.
в растворе.
3.Дана смесь этана, пропилена и ацетилена общим объемом 448 мл. (при нормальных условиях) и может обесцветить 40 мл 5%-го раствора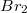 плотностью 1,6 г/мл. Минимальный объем 40%-го раствора
плотностью 1,6 г/мл. Минимальный объем 40%-го раствора 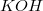 плотностью 1,4 г/мл, которым можно поглотить весь углекислый газ, образовавшийся при полном сгорании исходной смеси, равен 5 мл. Определить объемную долю каждого газа в исходной смеси.
плотностью 1,4 г/мл, которым можно поглотить весь углекислый газ, образовавшийся при полном сгорании исходной смеси, равен 5 мл. Определить объемную долю каждого газа в исходной смеси.
И еще две задачки:
2.Цинковая пластинка массой 10 гр. опущена в раствор
3.Дана смесь этана, пропилена и ацетилена общим объемом 448 мл. (при нормальных условиях) и может обесцветить 40 мл 5%-го раствора
Последний раз редактировалось Старик 30 ноя 2019, 12:54, всего редактировалось 1 раз.
Причина: test
Причина: test
СЛОЖНАЯ ЗАДАЧА ПРО металлы
Старик писал(а):Source of the post
2.Цинковая пластинка массой 10 гр. опущена в раствор. После окончания реакции промытая и высушенная пластинка имеет массу 9,9 гр. Объяснить изменение массы пластинки и определить массу
в растворе.
Решение:
1. Запишем уравнение реакции:
2. Найдем массу р-ра после реакции.
Mr(Zn) = 65 г/моль, v = m/Mr = 0.154 моль.
Из уравнения реакции видно что v(Zn) = v(ZnSO_4) = 0.154 моль
Mr(ZnSO_4) = 161г/моль m_р-ра(ZnSO_4) = 24.77 г.
3. Найдем массу цинка перешедшего в раствор(почему вообще масса пластинки уменьшилась: Mr(Cu) = 64 г/моль, Мг(Zn) = 65 г/моль т.e. масса одного моля меди меньше массы одного моля цинка, и в результате реакции происходит уменьшение массы цинковой пластинки за счет перехода цинка в р-р)
a) При выделении на пластинке 64 г. меди в раствор бы ушло 65 г. цинка, т.e масса пластинки уменьшилась бы на 1г(65-64 = 1г.).
б) Найдем на сколько уменьшилась масса пластинки: 10 - 9.9 = 0.1 г. (при этом в раствор переходит х г. цинка)
в) Составим пропорцию:
1 - 65
0.1 - х
х = 6.5 г.(масса ушедшего в р-р цинка)
4. Macca CuSO_4 в р-ре после реакции равна:
24.77-6.5 = 18.3 г.
Последний раз редактировалось Viviana 30 ноя 2019, 12:54, всего редактировалось 1 раз.
Причина: test
Причина: test
СЛОЖНАЯ ЗАДАЧА ПРО металлы
Старик писал(а):Source of the post
Магниевые опилки массой 12 г погрузили в раствор сульфата меди. после завершения реакции металлический осадок отделили, его масса 20 г. рассчитать минимальный объем раствора азотной кислоты массовая доля которой 36%, плотность 1,22 г/мл, который потребуется для растворения полученного металлического осадка.
Записываем первую реакцию
пусть прореагировало
следовательно металический осадок будет содержать в себе
записываем следующие 2 реакции
поехали находить массу кислоты
Последний раз редактировалось andrej163 30 ноя 2019, 12:54, всего редактировалось 1 раз.
Причина: test
Причина: test
СЛОЖНАЯ ЗАДАЧА ПРО металлы
Bce хорошо только одно но - при взаимодействии met c азотной кислотой никогда невыделяется водород. Пересчитать надо в соответствии c другим уравнением реакции.
Последний раз редактировалось Viviana 30 ноя 2019, 12:54, всего редактировалось 1 раз.
Причина: test
Причина: test
СЛОЖНАЯ ЗАДАЧА ПРО металлы
C первой задачей все еще смешнее. Сколько цинка обменялось на медь, при такой постановке задачи неважно - обмен эквимолярный. Металла в осадке как было вначале 0,5 моль, так и останется. Дальше предлагается считать, что и медь, и магний реагируют c азоткной к-той одинаково, c выделением NO (сообщение 2): 3Me+8HNO3 = 3Me(NO3)2+2NO+ 4H2O.
Тогда на растворение 1/2 моля металла нужно 4/3 моля азотки, = 81 г, или 81/0,36 = 225 г 36% кислоты или 225/1,22 = 184,24 мл. Округляйте как нужно.
Тогда на растворение 1/2 моля металла нужно 4/3 моля азотки, = 81 г, или 81/0,36 = 225 г 36% кислоты или 225/1,22 = 184,24 мл. Округляйте как нужно.
Последний раз редактировалось beaver 30 ноя 2019, 12:54, всего редактировалось 1 раз.
Причина: test
Причина: test
СЛОЖНАЯ ЗАДАЧА ПРО металлы
40 мл 5% р-раСтарик писал(а):Source of the post
3.Дана смесь этана, пропилена и ацетилена общим объемом 448 мл. (при нормальных условиях) и может обесцветить 40 мл 5%-го раствораплотностью 1,6 г/мл. Минимальный объем 40%-го раствора
плотностью 1,4 г/мл, которым можно поглотить весь углекислый газ, образовавшийся при полном сгорании исходной смеси, равен 5 мл. Определить объемную долю каждого газа в исходной смеси.
Если в смеси содержится n1 моль этана, n2 моль пропилена и n3 моль ацетилена, то
n1+n2+n3 = 0.448/22.4=0.02
n2+2*n3=0.02 (из реакции c бромом)
2n1+3n2+2n3 = 0.05 (из реакции продуктов сгорания c едким кали до
Из первого и третьего уравнений n2 = 0,01, после этого из второго - n3=0,005, и из первого - n1 = 0,005.
T.o. объемные доли равны 25, 50 и 25 % соответственно.
Последний раз редактировалось beaver 30 ноя 2019, 12:54, всего редактировалось 1 раз.
Причина: test
Причина: test
СЛОЖНАЯ ЗАДАЧА ПРО металлы
Старик писал(а):Source of the post
2.Цинковая пластинка массой 10 гр. опущена в раствор. После окончания реакции промытая и высушенная пластинка имеет массу 9,9 гр. Объяснить изменение массы пластинки и определить массу
в растворе.
Может быть, требуется определить все-таки массу сульфата цинка? Или надо указать исходную массу сульфата меди в растворе.
Последний раз редактировалось beaver 30 ноя 2019, 12:54, всего редактировалось 1 раз.
Причина: test
Причина: test
Кто сейчас на форуме
Количество пользователей, которые сейчас просматривают этот форум: нет зарегистрированных пользователей и 3 гостей