Я уже четвёртую неделю над шестью задачками сижу, последние две(эта одна из них) вообще нерешаемы.
Это вообще решаемо?
Это вообще решаемо?
Через водный раствор хлорида натрия(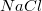 ) пропускали в течение 160.8 минут постоянный электрический ток силой 10A. Электроды инертные. Определить какие вещества, и в каком количестве образовались на электродах.
) пропускали в течение 160.8 минут постоянный электрический ток силой 10A. Электроды инертные. Определить какие вещества, и в каком количестве образовались на электродах.
Я уже четвёртую неделю над шестью задачками сижу, последние две(эта одна из них) вообще нерешаемы.
Я уже четвёртую неделю над шестью задачками сижу, последние две(эта одна из них) вообще нерешаемы.
Последний раз редактировалось qwertylol 30 ноя 2019, 13:52, всего редактировалось 1 раз.
Причина: test
Причина: test
Это вообще решаемо?
Если я не напутал, то может быть так:
записываем уравнение без коэфициентов вначале, потом окисление, востановление и конечное уравнение.

найдём эквивалент нашей соли

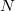 - катионов в формуле
- катионов в формуле
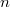 - формальный заряд катиона
- формальный заряд катиона
найдём массу соли

теперь находим объёмы газов

ну вот, вроде бы и усё.
записываем уравнение без коэфициентов вначале, потом окисление, востановление и конечное уравнение.
найдём эквивалент нашей соли
найдём массу соли
теперь находим объёмы газов
ну вот, вроде бы и усё.
Последний раз редактировалось andrej163 30 ноя 2019, 13:52, всего редактировалось 1 раз.
Причина: test
Причина: test
Это вообще решаемо?
Андрей, огромное спасибо! Я пока не разобрался в решении, но на эту ночь я занятием обеспечен :blink: .
Теперь от последнего зачёта меня отделяет последняя задача(извините за тавтологию).
Предложить схему электрического процесса получения покрытия из платины на металлическом изделии. Какое количество электричества надо пропустить через раствор электролита, чтобы отложить слой платины массой 0.195г?
Теперь от последнего зачёта меня отделяет последняя задача(извините за тавтологию).
Предложить схему электрического процесса получения покрытия из платины на металлическом изделии. Какое количество электричества надо пропустить через раствор электролита, чтобы отложить слой платины массой 0.195г?
Последний раз редактировалось qwertylol 30 ноя 2019, 13:52, всего редактировалось 1 раз.
Причина: test
Причина: test
Это вообще решаемо?
qwertylol писал(а):Source of the post
Андрей, огромное спасибо! Я пока не разобрался в решении, но на эту ночь я занятием обеспечен :blink: .
Теперь от последнего зачёта меня отделяет последняя задача(извините за тавтологию).
Предложить схему электрического процесса получения покрытия из платины на металлическом изделии. Какое количество электричества надо пропустить через раствор электролита, чтобы отложить слой платины массой 0.195г?
Для условий этой задачи годится электролиз раствора четыреххлористой платины. 0.195 г это - 0.001M платины. Вот и считайте по аналогии c задачей, которую Андрей уже решил.
при электролизе будет на одном электроде платина, на другом - хлор. Только имейте в виду, что платина имеет в реакции формальную валентность +4
Последний раз редактировалось Natrix 30 ноя 2019, 13:52, всего редактировалось 1 раз.
Причина: test
Причина: test
Это вообще решаемо?
T.e. решение таково:

A если ответ в числах фарадея нужен :blink: ? Там соотношение 1 к 1 или как-то переводить надо?
A если ответ в числах фарадея нужен :blink: ? Там соотношение 1 к 1 или как-то переводить надо?
Последний раз редактировалось qwertylol 30 ноя 2019, 13:52, всего редактировалось 1 раз.
Причина: test
Причина: test
Это вообще решаемо?
Погодите, у меня, почему-то, не такой ответ выходит.
Кароч, реакция будет вида

теперь реакции на катоде и аноде

по молекулярной реакции находим массу хлорида

такс, теперь кулоны

A что вы имеете ввиду под числами Фарадея. Я знаю только одно число, которое кстати мы использывали в нахождении кулонов.
Постоянная Фарадея равна

 - элементарный заряд (электрона)
- элементарный заряд (электрона)
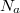 - число Авагадро
- число Авагадро
Кароч, реакция будет вида
теперь реакции на катоде и аноде
по молекулярной реакции находим массу хлорида
такс, теперь кулоны
A что вы имеете ввиду под числами Фарадея. Я знаю только одно число, которое кстати мы использывали в нахождении кулонов.
Постоянная Фарадея равна
Последний раз редактировалось andrej163 30 ноя 2019, 13:52, всего редактировалось 1 раз.
Причина: test
Причина: test
Это вообще решаемо?
Андрей, вы снова меня выручаете!(репутацию повышу как только пройдёт 24 часа c момента прошлого повышения) He знаю как вас отблагодарить. Кстати, последняя задача решается явно не по аналогии c первой.
Последний раз редактировалось qwertylol 30 ноя 2019, 13:52, всего редактировалось 1 раз.
Причина: test
Причина: test
Кто сейчас на форуме
Количество пользователей, которые сейчас просматривают этот форум: нет зарегистрированных пользователей и 3 гостей